Когда мы думаем о своем здоровье, то разделяем наши тела с нашими кишечными бактериями. На самом деле, можно сказать, что многие функции нашего организма зависят от бактерий, которые находятся в нашем кишечнике. Эти бактерии могут сделать нас худыми или толстыми, здоровыми или больными, счастливыми или подавленными. Наука только начинает понимать, как микрофлора кишечника влияет на нашу жизнь. В этой статье мы рассмотрим известную информацию о наших бактериях кишечника, в том числе о том, как они формируют наши тела и наш разум.
Для изучения способов улучшения состава кишечной микрофлоры вы можете прочесть более раннюю статью: Микрофлора кишечника: что может её улучшить или ухудшить?
Содержание
Микрофлора кишечника – что это?
Большие сообщества микробов (бактерий, грибков, вирусов), живущих в нашем кишечнике, называются микрофлорой кишечника. Наш кишечник заселен 1013 – 1014 (до ста триллионов) бактерий. На самом деле, менее половины клеток в организме человека принадлежат к телу. Более половины клеток нашего организма – это бактерии, населяющие кишечник и кожу.
Ранее считалось, что микробов в организме в десять раз больше, чем клеток тела, но новые расчеты показывают на соотношение близкого к 1:1. [И] В кишечнике взрослого человека содержится 0,2 – 1 кг бактерий. [И]
Кишечные бактерии играют много полезных ролей в нашем организме:
- Помогают получить больше энергии из пищи (И)
- Обеспечивают выработку важных витаминов, таких как В и К
- Укрепляют кишечный барьер
- Улучшают работу иммунной системы
- Защищают кишечник от вредных и условно-патогенных микроорганизмов
- Способствуют процессу выработки желчных кислот
- Разлагают токсины и канцерогенные вещества
- Являются необходимым условием для нормального функционирования органов, особенно кишечника и мозга
Несбалансированная микрофлора делает нас более восприимчивыми к инфекциям, иммунным нарушения и воспалениям.
Таким образом, улучшение микрофлоры кишечника – это перспективный подход для борьбы с целым рядом распространенных заболеваний. [И]
Состав кишечной микрофлоры
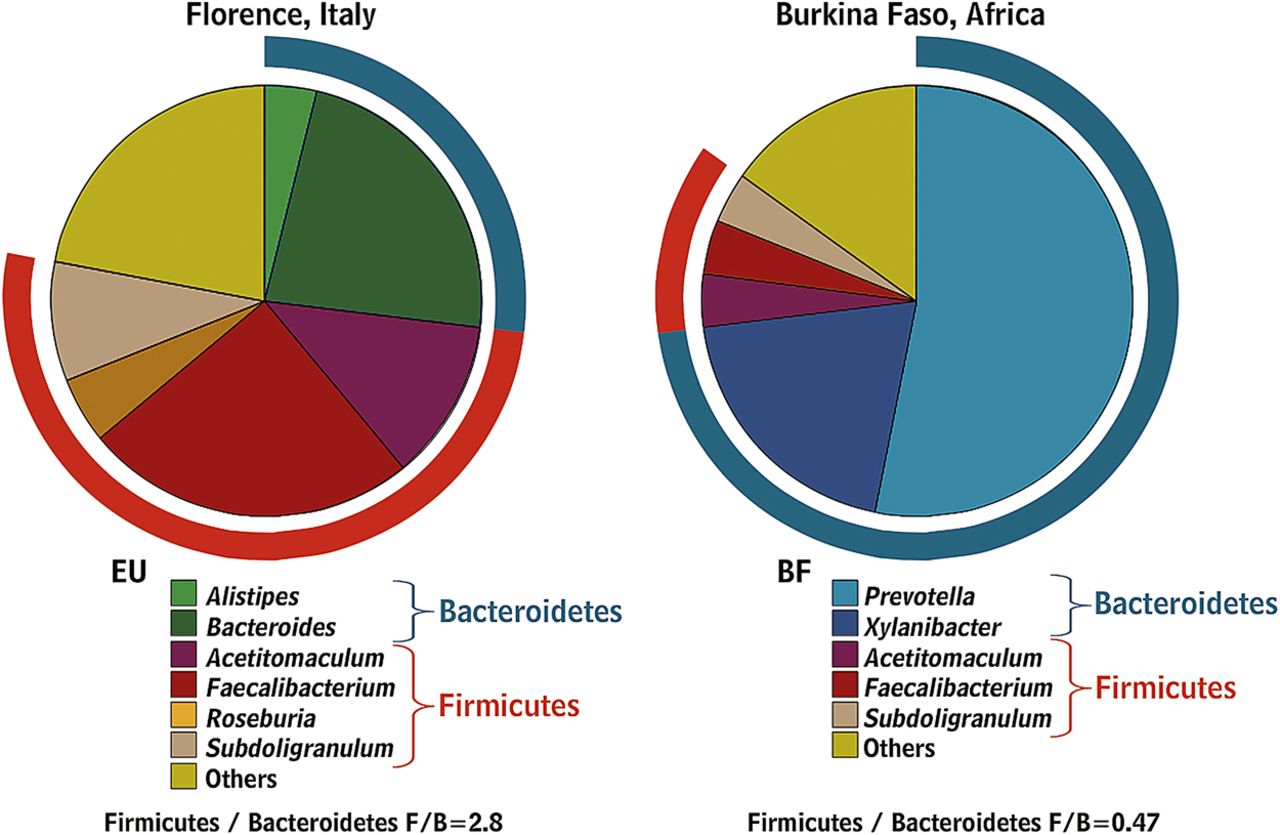
Наука считает, что наш кишечник населяет более 2.000 видов бактерий. Большинство бактерий в кишечнике (80-90%) принадлежат к 2-м группам: Фирмикутам и Бактероидам. [И]
В тонком кишечнике время движения пищи достаточно короткое и обычно содержатся высокие уровни кислот, кислорода, и противомикробных агентов. Все это ограничивает рост бактерий. Только быстрорастущие бактерии, которые устойчивы к действию кислорода и способны сильно прикрепляться к кишечной стенке, способны выжить в тонком кишечнике. [И]
В отличие от этого, толстый кишечник имеет большое и разнообразное сообщество бактерий. Для своей жизнедеятельности они используют сложные углеводы, которые не перевариваются в тонком кишечнике. [И]
Развитие и старение микрофлоры кишечника
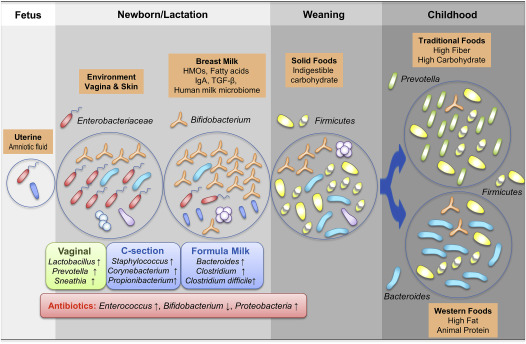
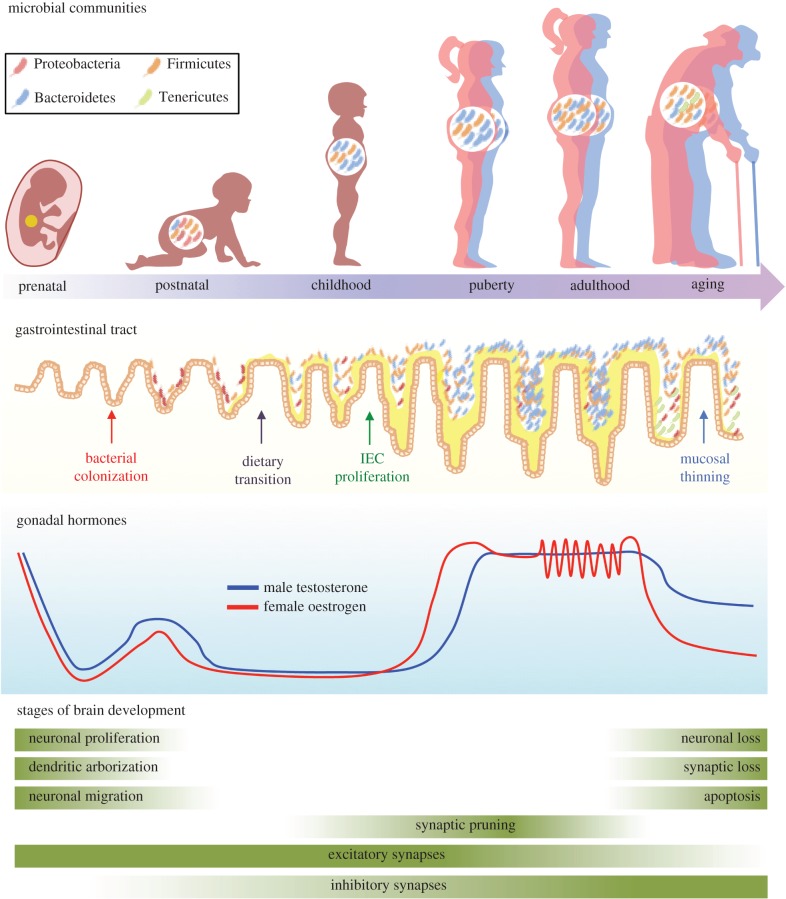
Ранее наука и медицина считала, что микрофлора кишечника формируется после рождения. Однако некоторые последние исследования показывают, что плацента также может иметь свою собственную уникальную микрофлору. Таким образом, люди могут быть колонизированы бактериями еще во время нахождения в утробе матери. (И)
При обычном рождении кишечник новорожденного получает микробы, как от матери, так и от окружающей среды. При достижении годовалого возраста, каждый человек получает уникальный, свойственный только ему, бактериальный профиль. К 3-м годам жизни состав микрофлоры кишечника ребенка становится похожим на микрофлору взрослого человека.
Однако в ответ на активность гормонов в период полового созревания микрофлора кишечника меняется в очередной раз. В результате возникают различия между мужчинами и женщинами. В большей степени меняется микрофлора у мальчиков под воздействием гормона тестостерона, а у девочек бактерии получают способность изменять свой количественный состав при воздействии менструальных циклов.
Во взрослом возрасте состав кишечной микрофлоры относительно стабилен. Однако, он все еще может быть изменен жизненными событиями, например приемом антибиотиков, стрессом, гиподинамией, ожирением и в большой степени – диетой.
У людей старше 65 лет микробное сообщество смещается в сторону увеличения численности Бактероидов. В целом, бактериальные метаболические процессы, такие, как производство короткоцепочечных жирных кислот (КЖК) сокращаются, в то время как распад белков увеличивается.
Микрофлора открывает новую захватывающую главу в науке
Наука только начинает понимать множество ролей, которые играют кишечные микробы в наших телах. Исследования, посвященные изучению бактерий кишечника, растут в геометрической прогрессии, и большая часть этих исследований совершенно недавние.
Однако, все еще существует много вопросов, которые остаются без ответа. Тем не менее, мы можем ожидать много новых захватывающих прорывов в ближайшие годы.
Как бактерии в кишечнике влияют на ваше здоровье
Микрофлора кишечника производит необходимые витамины
Кишечные бактерии вырабатывают витамины, некоторые из которых мы не способны производить сами:
- Витамин В-12
- Фолиевая кислота / Витамин В-9
- Витамин К
- Рибофлавин / Витамин В-2
- Биотин / Витамин В-7
- Никотиновая кислота / Витамин В-3
- Пантотеновая кислота / Витамин В-5
- Пиридоксин / Витамин В-6
- Тиамин / Витамин В-1
Микрофлора кишечника производит жирные кислоты
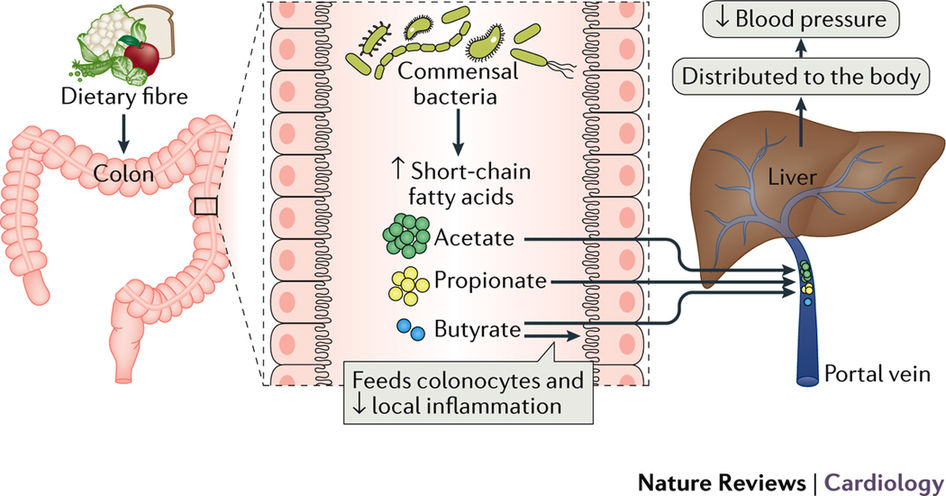
Кишечные бактерии производят короткоцепочечные жирные кислоты (SCFAs). Эти кислоты включают в себя – бутират, пропионат и ацетат.
Эти SCFAs (короткоцепочечные жирные кислоты) проявляют много важных функций в нашем теле:
- Обеспечивают примерно 10% от суточной калорийности при переваривании пищи
- Активизируют АМФ и стимулируют похудение
- Пропионат уменьшает жировые накопления в печени, снижает в крови уровень холестерина, а также повышает чувство сытости
- Ацетат уменьшает аппетит
- Бутират уменьшает воспаления и борется с раком
- Ацетат и пропионат увеличивают количество циркулирующих Treg (регуляторных T-клеток), которые способны уменьшать чрезмерные иммунные реакции.
Диеты с большим количеством клетчатки и меньшим количеством мяса, например, вегетарианская или средиземноморская диеты, приводят к увеличению количества SCFAs (короткоцепочечных жирных кислот).
Микрофлора кишечника меняет наш мозг
Кишечные бактерии общаются с нашим мозгом, они способны влиять на наше поведение и умственные способности. Подобное взаимодействие работает в двух направлениях. Микробы кишечника и головной мозг влияют друг на друга, и наука называет связь – «ось кишечник-мозг».
Каким образом кишечник и мозг общаются?
- Через блуждающий нерв и вегетативную нервную систему.
- Бактерии вырабатывают серотонин, ГАМК, ацетилхолин, дофамин и норадреналин в кишечнике. Через кровь эти вещества могут проникать в мозг.
- Короткоцепопчечные жирные кислоты (SCFAs) производятся микрофлорой кишечника, которые являются источником энергии для нервных и глиальных клеток в головном мозге.
- Через иммунные клетки и воспалительные цитокины.
Кишечные бактерии могут улучшить-ухудшить настроение и поведение
Когда микрофлора кишечника нарушается в результате инфекции или воспаления, это может ухудшить наше психическое здоровье. Люди с воспалительными заболеваниями кишечника часто проявляют признаки депрессии или тревожности.
В одном исследовании с участием 46 людей с депрессией было обнаружено, что в их кишечной микрофлоре выросло количество Бактероидов, Протеобактерий и Актинобактерий, а также произошло снижение количества Фирмикутов.
В другом контролируемом исследовании с 40 здоровыми взрослыми людьми, пробиотики смогли помочь снизить уровень негативных мыслей, проявляемые в виде грустного настроения.
Исследование с участием 710 человек, показало, что ферментированные продукты (с высоким содержанием пробиотиков) могут помочь уменьшить тревожность людей.
Интересно, что когда крысам передается кишечная микрофлора от людей с депрессией, то и у крыс быстро развивается депрессия. С другой стороны, “хорошие” бактерии, такие как Лакто – и Бифидобактерии, снижают тревожность и депрессивные синдромы у тех же крыс. Как оказалось, эти бактерии увеличивают содержание триптофана в крови у крыс. Триптофан необходим для синтеза серотонина (так называемого «гормона счастья»).
Интересно, что стерильные мыши (без кишечных бактерий) проявляли меньшее беспокойство. У них было обнаружено больше серотонина в мозгу (гиппокамп). Подобное спокойное поведение можно было изменить с помощью бактериальной колонизации в их кишечнике, но такое воздействие через микробов достигало результата только у молодых мышей. Это показывает, что микрофлора кишечника играет важную роль в развитии мозга у детей.
Исследование с участием более 1-го миллиона человек показало, что лечение пациентов одним типом антибиотика повышает риск депрессии. Риск развития депрессии или беспокойства повышался при повторном использовании антибиотиков и с увеличением количества одновременного приема разных антибиотиков.
Микрофлора кишечника может улучшить и ухудшить функцию работы мозга
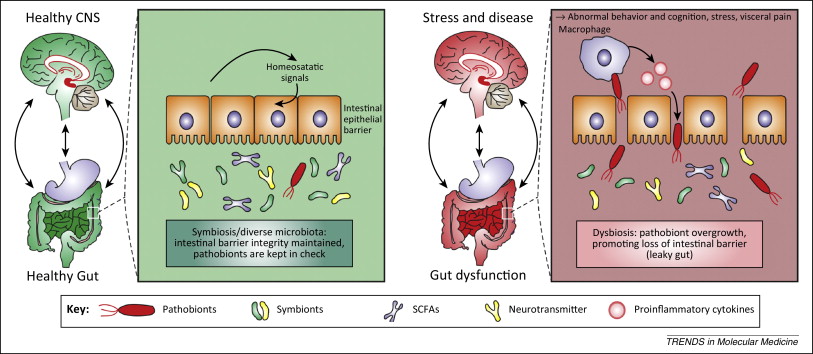
В одном исследовании было продемонстрировано, что негативные изменения в кишечной микрофлоре приводили к ухудшению работы мозга (на примере 35 взрослых и 89 детей).
В другом исследовании у стерильных мышей и у мышей с бактериальными инфекциями были выявлены проблемы с памятью. Но добавление в их рацион пробиотиков в течение 7 дней до и во время инфекционных заболеваний приводило к уменьшению нарушений работы мозга.
Длительное применение антибиотиков у мышей снижало производство новых нервных клеток в мозге (гиппокампе). Но это нарушение было уменьшено или полностью отменено при дополнительном приеме пробиотиков или увеличением физической активности.
Продукты питания могут также влиять на когнитивную функцию, изменяя микрофлору кишечника. Западная диета (высокое содержание насыщенных жиров и сахара) способствует уменьшению в кишечнике у мышей Бактероидов (Bacteroidetes) и увеличению Фимикутов (Firmicutes) вместе с Протеобакериями (Proteobacteria). Подобные изменения связаны с развитием нарушения работы мозга.
Если переносили кишечные бактерии от мышей, которых кормили Западной диетой, другим мышам, то мыши-получатели этой микрофлоры проявляли увеличение тревожности и нарушения в обучении и памяти.
С другой стороны, “хорошие бактерии” помогают улучшить работу мозга. Как было показано в исследованиях, несколько типов пробиотиков смогли улучшить когнитивные способности у подопытных животных.
Микрофлора может сделать вас больше или меньше восприимчивыми к стрессу

Ваши кишечные бактерии определяет способ, которым вы реагируете на стресс. Наша микрофлора программирует гипоталамо-гипофизарно-надпочечниковую ось в самом начале нашей жизни. Это, в свою очередь, определяет нашу реакцию на стресс в дальнейшей жизни.
Кишечные бактерии могут способствовать развитию посттравматического стрессового расстройства (ПТСР). Опыты над животными показали, что дисбаланс в микрофлоре кишечника (дисбактериоз) делает поведение этих животных более восприимчивое к развитию ПТРС после травматического события.
Стерильные мыши проявляют преувеличенные реакции на стресс (у них гипоталамо-гипофизарно-надпочечниковая ось находится в гиперактивном состоянии). Такие животные демонстрируют более низкие показатели BNDF – фактора, который необходим для выживания нервных клеток. Но если эти мыши получали Бифидобактерии в начале своей жизни, то гипоталамо-гипофизарно-надпочечниковая ось восстанавливалась к своему нормальному состоянию.
В исследовании с участием 581 студента было продемонстрировано, что прием пробиотиков на основе Бифидобактерий приводило к уменьшению диареи (или дискомфорта в кишечнике) и к снижению заболевания простудой (гриппом) во время стрессовых состояний (экзаменов).
Аналогичным образом бифидобактерии B.longum снижали уровень стресса (измерялся кортизол) и тревожности у 22 здоровых добровольцев.
Наконец, пробиотики с L.caseiпомогали снижать показатели кортизола, повышенный уровень серотонина и уменьшали количество стрессовых симптомов в эксперименте с 219 участниками.
Микрофлора улучшает кишечный барьер
Слизь в кишечнике действует как смазка и защищает стенку кишечника от раздражения, когда по нему продвигается пища. Но этот слизистый слой тоньше у стерильных (c отсутствием микрофлоры) животных. Вот почему такие животные более склонны к инфекциям, а также испытывают более интенсивные и продолжительные кровотечения при воспалительных заболеваниях кишечника.
Микрофлора кишечника может вызвать ишемическую болезнь сердца
Ишемическая болезнь сердца (ИБС) является типичным нарушением работы оси мозг-кишечник-микрофлора. Как следует из исследований, примерно 10-30% пациентов с ИБС показывают инфекции или воспаление кишечника. Это состояние связано с изменениями микрофлоры кишечника в худшую сторону.
Зачастую ишемическая болезнь сердца возникает после применения антибиотиков.
Люди с ИБС показывают в своих анализах меньшее микробное разнообразие и их микрофлора кишечника является более неустойчивой. В их кишечнике находится меньше лактобацилл и бифидобактерий. У некоторых пациентов с ишемической болезнью сердца изменяется соотношение Фирмикутов / Бактероидов, что связывается с развитием депрессии и тревоги.
Уровни короткоцепочечных жирных кислот SCFAs (уксусная кислота, пропионовая кислота и масляная кислота) у таких людей после еды демонстрируют низкие значения.
Мета-анализ из 15 исследований с общим участием 1.793 человек показал, что пробиотики улучшали симптомы при ишемической болезни сердца. Аналогичное улучшение симптоматики произошло в 58% случаев из 48 пациентов с ИБС при фекальной трансплантации здоровой микрофлоры от доноров.
Наконец, в 2-х исследованиях с 12 и 87 участниками с ишемической болезнью было обнаружено, что антибиотик рифампицин смог помочь в лечении ИБС, вероятно, предотвратив избыточный рост плохих бактерий.
Кишечные бактерии могут сделать вас худее и полнее
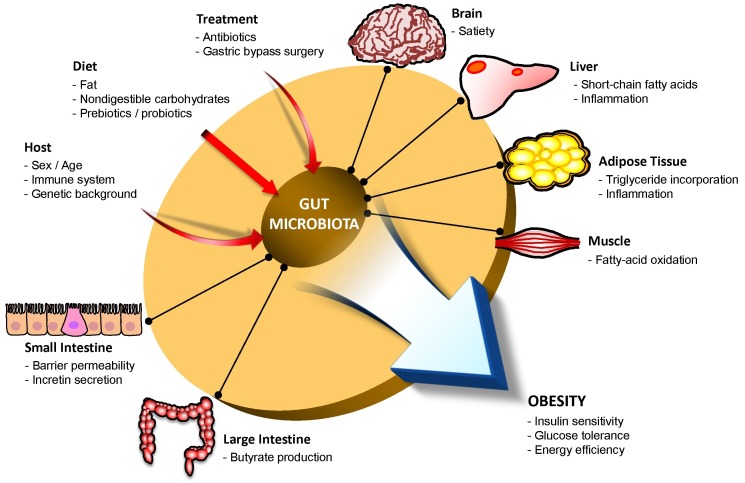
Люди и животные с ожирением демонстрируют более низкое разнообразие бактерий в кишечнике.
Два различных исследования с участием 12 взрослых и 78 детей показали, что люди с ожирением имели в кишечнике больше Бактероидов и Фирмикутов. У них также было меньше короткоцепочечных жирных кислот (SCFAs), уменьшение которых связано с развитием ожирения.
Несколько крупных исследований на людях (154 участников) подтвердили, что ожирение было связано с:
- Снижением количества бактерий в кишечнике
- Уменьшением бактериальной плотности на единицу площади
- Увеличение активности у бактерий генов, которые перерабатывают сахар и жиры для получения энергии.
При исследованиях на мышах и крысах было подтверждена связь между количеством Бактероидов и полнотой тела. Количество Бактероидов было больше у худых животных, а повышенное количество Фирмикутов определялось у тучных мышей. При практике низкокалорийной диеты доля Бактероидов также увеличивается.
Мыши с ожирением имели коэффициент 20:80 – соотношение Бактероидов к Фирмикутам. Худые животные демонстрировали коэффициент 40:60. Избыточное количество Фирмикутов помогало толстым мышам получать больше калорий от потребляемого рациона питания, что приводило к нарастанию степени ожирения.
Вполне вероятно, что нарушенная микрофлора кишечника может вызвать ожирение. В одном исследовании, после передачи микрофлоры кишечника от мышей с ожирением стерильным мышам, происходил рост веса тела и появление ожирения у этих стерильных мышей.
Увеличение использования антибиотиков и их негативное влияние на кишечную флору может быть одной из причин эпидемии ожирения, которую мы наблюдаем сегодня.
Участие в исследовании 436 матерей с их ребенком показало, что воздействие антибиотиков во время беременности повышает риск детского ожирения на 84%. Раннее применение антибиотиков у молодых мышей делает их толще.
Какие “хорошие бактерии” уменьшены в микрофлоре кишечника у людей с ожирением:
- Бифидобактерии в целом (разнообразие и количество)
- Akkermansia muciniphila
Микрофлора кишечника может помочь в лечении диабета 2-го типа
Микрофлора кишечника может играть важную роль в развитии метаболических заболеваний. Например, в исследовании с участием 345 человек было показано, что у людей с диабетом в кишечнике было меньше бактерий, производителей бутирата, и больше – болезнетворных бактерий.
Бактерии Akkermansia muciniphila и Faecalibacterium prausnitziiявляются микроорганизмами, продуцирующими бутират. Исследование с участием 121 человек показало, что эти бактерии были снижены у людей с предиабетом и с впервые выявленным сахарным диабетом 2-го типа. Известно, что Akkermansia muciniphila повышает чувствительность к инсулину у мышей.
При опытах на мышах было обнаружено, что пробиотики С. butyricum и L. casei улучшали симптомы диабета (уровень глюкозы натощак, толерантность к глюкозе и количество бутират-продуцирующих бактерий). Обе эти бактерии смогли понизить количество Фирмикутов и увеличить число Бактероидов, а также бутират-производителей.
Лекарственный препарат метформин, который используется для лечения диабета 2-го типа, также увеличивает количество бактерий Akkermansia muciniphila и лактобактерий.
Бактерии из кишечника вносят вклад в заболевания сердца
Исследования на человеке и животных показывают, что некоторые кишечные бактерии способствуют развитию болезней сердца. Известно, что пациенты с атеросклерозом имеют измененную флору кишечника.
Микрофлора кишечника может усугубить заболевание сердца, производя слишком много TMAO. Триметиламиноксид (ТМАО, также известен как триметиламин N-оксид) является побочным продуктом и вызывает склерозирование артерий (развитие атеросклероза).
В исследовании с участием 119 человек было определено, что люди с заболеваниями сердца имели в микрофлоре кишечника больше Фирмикутов и меньше Бактероидов.
Микрофлора кишечника важна для здоровья печени
Микробный дисбаланс (дисбактериоз) может играть роль в развитии неалкогольного ожирения печени (НАЖБЛ). [И] Люди с жировой болезнью печени демонстрируют повышенную распространенность Фирмикутов, что очень похоже на бактериальный дисбаланс при ожирении.
В исследовании с участием 66 пациентов получение бактерий Bifidobacterium лонгум в дополнении к пребиотикам и соблюдение здорового образа жизни помогло улучшить состояние при жировой дистрофии печени. Пробиотики способствовали уменьшению уровня АСТ (аспартатаминотрансфераза, фермент печени), ФНО (фактора некроза опухоли, воспалительного белка), С-реактивного белка, снижению инсулинорезистентности и уменьшению повреждения самой печени.
При экспериментах на мышах микрофлора помогала защищать повреждение печени при воздействии на неё токсинов.
Микрофлора кишечника способствует развитию иммунитета
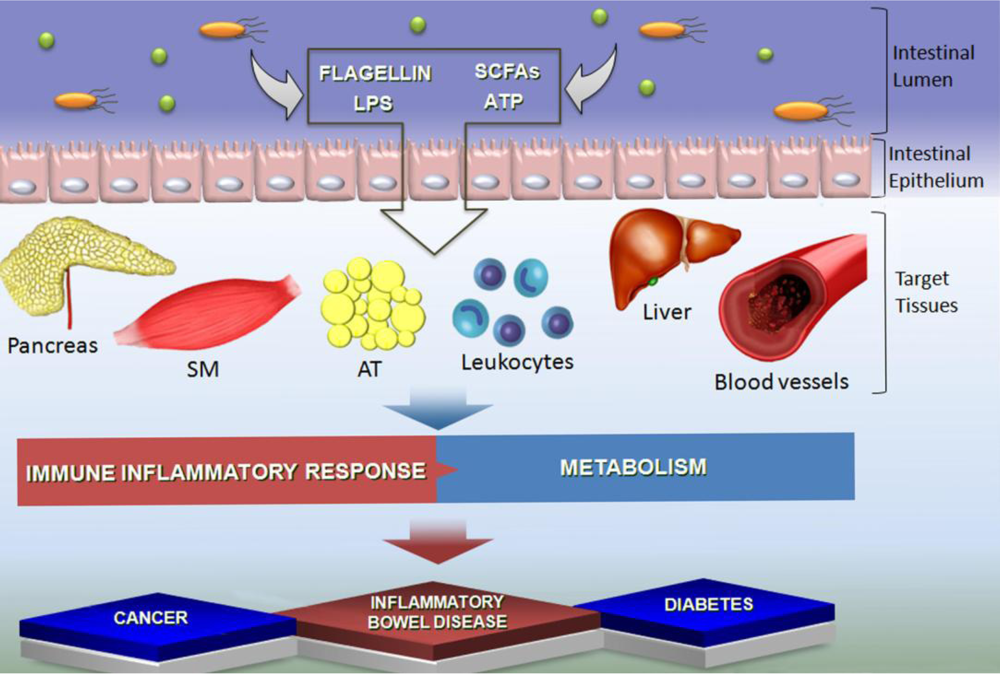
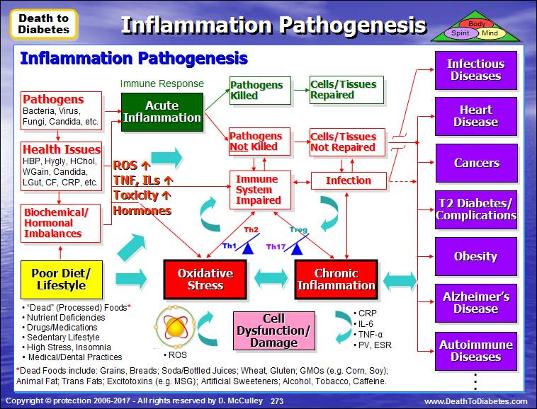
Наш иммунитет тесно связан с кишечником. Примерно 70% наших иммунных клеток находятся в кишечнике. В кишечнике происходит взаимодействие бактерий с иммунными клетками, а точнее, происходит программирование иммунного ответа с помощью активизации или уменьшения активности Th1/Th2 (воспалительного и противовоспалительного путей иммунного ответа), Th17-лимфоцитов, Treg – циркулирующих иммунных клеток.
Известно, что при беременности материнская иммунная система смещается в сторону Th2 иммунного ответа (противовоспалительного). Такое изменение иммунитета вызывает у ребенка смещение иммунной функции в направление Th2 ответа. [И] Однако, в течение первых недель и месяцев жизни кишечные бактерии помогают младенцам постепенно увеличивать активность воспалительного иммунного ответа Th1 и восстановить баланс Th1/Th2.
У младенцев, родившихся в результате кесарева сечения, с задержкой активируется иммунитет типа Th1. Снижение скорости формирования Тh1 иммунного ответа происходит из-за измененной микрофлоры кишечника.
Микрофлора кишечника защищает от инфекций
Одно из основных преимуществ микрофлоры кишечника заключается в том, что она защищает нас от вредных микробов.
Кишечные бактерии ограждают нас от заражения с помощью:
- Своей борьбы за питательные вещества с вредными бактериями
- Производством побочных продуктов, препятствующих росту или активности опасных бактерий
- Поддержание непроницаемости слизистого барьера кишечника
- Стимуляцией нашего врожденного и адаптивного иммунитета
Стабильное состояние кишечной микрофлоры также предотвращает избыточный рост условно-патогенных микробов. Например, лактобактерии очень важны для предотвращения сильного роста бактерий Кандида albicans.
Кишечные бактерии также помогают против паразитов, таких как малярия. Как и люди, некоторые мыши более устойчивы к малярийной инфекции/ Когда стерильные мыши получали микрофлору от «более устойчивых» мышей, то они также становились более устойчивыми к малярии. Их иммунный ответ был повышен, и они показывали более низкую численность паразита. И наоборот, те стерильные мыши, которые получили бактерии кишечника от «восприимчивых» мышей, демонстрировали более высокую паразитарную нагрузку.
Антибиотики часто изменяют кишечную флору, тем самым снижая устойчивость против вредных бактерий.
Микрофлора подавляет воспаление
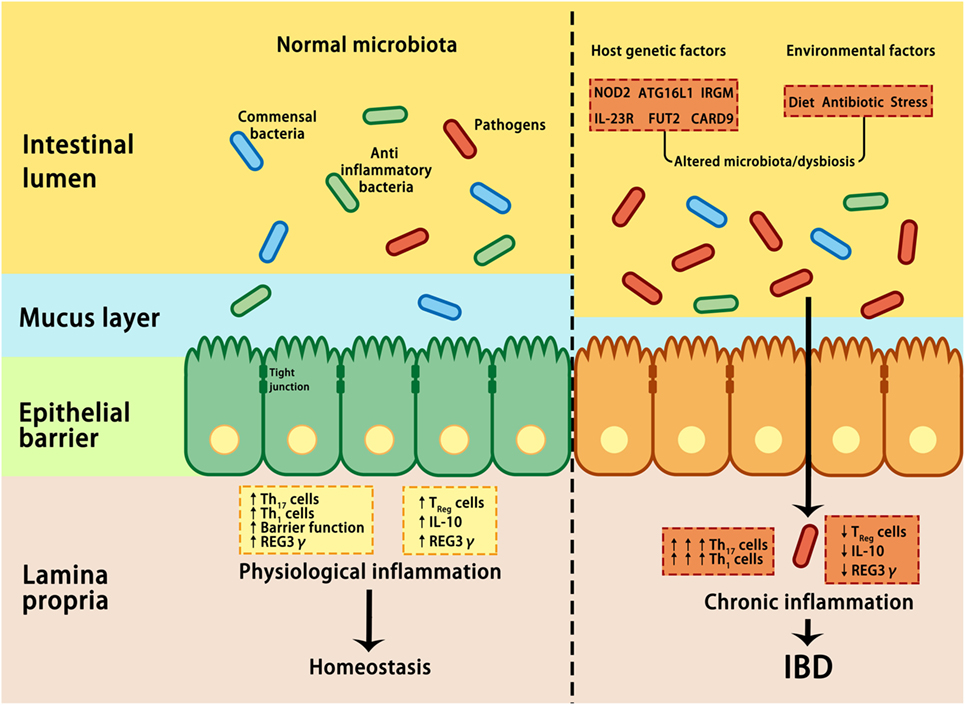
Кишечные бактерии могут увеличить производство th17 клеток и провоспалительных цитокинов (IL-6, IL-23, IL-1b). Или микрофлора кишечника может содействовать производству циркулирующих иммунных клеток T-reg, тем самым уменьшая воспаление. Оба этих пути развития зависят от того, какая микрофлора находится в вашем кишечнике.
Когда микрофлора выходит из равновесия (дисбактериоз кишечника), то это может увеличить воспаление. Подобное состояние способствует развитию хронических воспалительных заболеваний, таких как ишемическая болезнь сердца, рассеянный склероз, астма и ревматоидный артрит.
Когда мышей лечили антибиотиками, то в их кишечнике серьезно уменьшилось количество антивоспалительных T-reg иммунных клеток и мыши были более склонны к развитию воспаления.
К «хорошим» бактериям, которые способны защищать от воспалительных заболеваний, относят А. muciniphila и F. Prausnitzii.
Бактерии кишечника защищают от аллергии
Разбалансированная микрофлора кишечника увеличивает риск аллергий.
Исследование с участием 1.879 добровольцев показало, что люди с аллергиями имеют более низкое разнообразие их кишечной микрофлоры. У них было уменьшено количество бактерий Clostridiales (производителей бутирата) и увеличена численность бактерий Bacteroidales.
Несколько факторов, которые мешают нормальной жизнедеятельности микрофлоры кишечника и способствуют развитию пищевой аллергии:
- Отсутствие грудного вскармливания при младенчестве
- Применение антибиотиков и ингибиторов желудочной кислоты
- Использование антисептических средств
- Диета с низким уровнем пищевых волокон (клетчатки) с повышенным содержанием жиров.
Дети, которые росли на фермах (сельской местности), или приезжали туда на длительных отдых, показывают, как правило, низкий риск развития аллергий. Вероятно, это происходит из-за изменения микрофлоры у этих детей, чем у тех, кто проводит свою жизнь в городских условиях.
Другим защитным фактором против пищевой аллергии может быть наличие старших братьев и сестер, или домашних животных. Люди, проживающие в доме вместе с животными, показывают большее разнообразие микрофлоры кишечника.
Два исследования с участием 220 и 260 детей показали, что применение пробиотиков с Лактобактерия рамнозус (Lactobacillus rhamnosus) приводит к быстрому избавлению от разных типов пищевых аллергий. Действие пробиотика обусловлено увеличением бактерий, продуцирующих бутират.
Иммунотерапия вместе с пробиотиком из Lactobacillus rhamnosus привела к 82% излечению аллергий у 62 детей. [И] Наконец, мета-анализ из 25 исследований (4.031 детей) показал, что Lactobacillus rhamnosus снижет риск экземы.
Микрофлора защищает от развития астмы
При обследовании 47 детей, страдающих астмой, у них было выявлено низкое разнообразие бактерий в микрофлоре. Их микрофлора кишечника была похожа на микрофлору младенцев.
По аналогии с пищевой аллергией, люди могут защищать себя и своих детей от развития астмы с помощью улучшения микрофлоры:
- Грудное вскармливание
- Старшие братья и сестры
- Контакт с сельскохозяйственными животными
- Контакт с домашними животными
- Диета с высоким содержанием клетчатки (минимум 23 грамма в сутки)
С другой стороны, антибиотики повышают риск астмы. Два или более курсов антибиотиков во время беременности повышает риск астмы у потомства (на основе изучения 24.690 детей).
Еще одно исследование, проведенное у 142 детей, показало, что использование антибиотиков в раннем возрасте также увеличивало риск астмы. Препараты уменьшали разнообразие микрофлоры кишечника, снижали Актинобактерии и увеличивали Бактероиды. Снижение разнообразия бактериального составляющего кишечника сохранялось в течение более 2-х лет после получения антибиотиков.
У мышей на диете с высоким содержанием клетчатки было выявлено повышенное соотношение бактерий Фирмикутов по отношению к Бактероидам в микрофлоре кишечника. Подобное соотношение увеличивало выработку короткоцепочечных жирных кислот (SCFAs) и защищало от воспалений дыхательных путей.
Стерильные мыши показывают увеличенное число воспалений дыхательных путей. Колонизация их кишечника бактериями от молодых, но не взрослых мышей, защищает от развития этих воспалений. Это указывает на то, что в развитии иммунной системы есть специфическая по времени роль бактерий кишечника.
Микрофлора участвует в развитии воспалительных заболеваний кишечника
Воспалительные заболевания кишечника (ВЗК) обусловлены сочетанием генетических, экологических и бактериальных факторов. ВЗК проявляются в виде язвенного колита и болезни Крона. Считается, что эти заболевания могут быть непосредственно связаны с изменениями в кишечной микрофлоре.
Мета-анализ (7 исследований с участием 706 человек) показал, что люди с ВЗК, как правило, имеют более низкий уровень Бактероидов.
Другой мета-анализ (7 исследований с 252 испытуемыми) показал, что люди с воспалительными заболеваниями кишечника имеют больше вредных бактерий, в том числе Кишечной палочки и Шигелл.
Бактерия Faecalibacterium prausnitzii обнаруживается только у человека, является одной из производителей масляной кислоты (бутиратов) и способна защищать от воспалительных заболеваний кишечника. Количество этой бактерии снижено у людей с язвенным колитом и болезнью Крона.
Нарушения в микрофлоре кишечника способствуют развитию аутоиммунных заболеваний
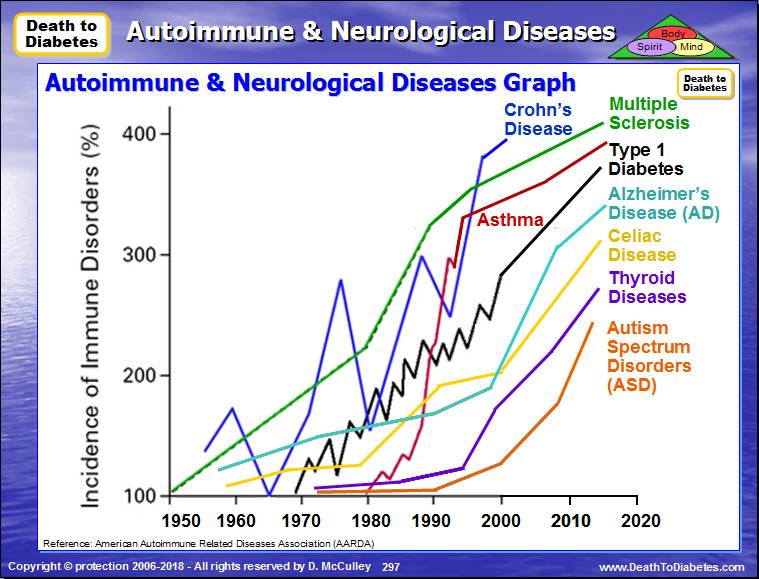
Младенцы все меньше и меньше подвержены воздействию микробов. Это может увеличить риск развития у них аутоиммунных расстройств, потому что отсутствие микробов в окружении тормозит развитие их иммунной системы. В результате не производятся в нужном количестве T-reg иммунные клетки, что приводит к потере толерантности к микроорганизмам.
Короткоцепочечные жирные кислоты (SCFAs), производимые кишечными бактериями, способствуют обретению терпимости путем увеличения циркулирующих Т-reg иммунных клеток.
Микрофлора кишечника при диабете 1-го типа
Исследование 8 детей с диабетом 1-го типа установило, что они обладают менее стабильной и менее разнообразной микрофлорой в кишечнике. У них меньше Фирмикутов и больше Бактероидов. В целом, у них было меньше производителей бутирата.
У мышей, склонных к диабету, и получавших антибиотики, вероятность развития диабета была меньше. При приеме антибиотиков у мышей увеличилось количество бактерии А. muciniphila. Это полезные бактерии, которые могут играть защитную роль против аутоиммунного сахарного диабета (диабета 1-го типа) у младенцев.
В другом исследовании было показано, что мыши, склонные к диабету, но получавшие в питании много ферментированных (квашеных) продуктов и богатых клетчаткой, с большей вероятностью могли получить диабет 1-го типа. Такой повышенный риск был связан с увеличением количества Бактероидов и уменьшение Фирмикутов.
Можно сказать, что существуют разные мнения о влиянии измененной микрофлоры на развитие диабета 1-го типа. И пока точно не известно, либо уже измененная микрофлора кишечника стимулирует диабет 1-го типа, или эта микрофлора меняется уже в результате болезни.
Микрофлора кишечника при волчанке
В одном исследовании с участием 40 пациентов с волчанкой было обнаружено, что в микрофлоре этих людей находилось больше Бактероидов и меньше Фирмикутов.
У молодых мышей, склонных к волчанке, в микрофлоре было больше Бактероидов, что похоже на людей. Мыши также демонстрировали меньше лактобактерий. Но добавление ретиноевой кислоты в питание этих мышей происходило восстановление лактобактерий и симптомы волчанки улучшались.
Также Лактобактерии смогли улучшить функцию почек у самок мышей с волчанкой, индуцированной воспалением почек. Это лечение также увеличило время их выживания. Известно, что Лактобактерии уменьшают воспаление в кишечнике путем изменения соотношения между иммунными клетками T-reg/Th17 в сторону увеличения T-reg. Эти циркулирующие клетки T-reg уменьшают уровень цитокина IL-6 и увеличивают уровень IL-10. Этот положительный эффект не наблюдался у самцов, что свидетельствует о гормональной зависимости эффекта воспаления.
У мышей, склонных к волчанке, развиваются изменения в их микрофлоре кишечника, если им давать воду с более кислой pH. В этом случае в из кишечнике увеличивается численность Фирмикутов и уменьшается Бактероидов. Эти мыши показывали меньшее количество антител и у них было замедленное прогрессирование болезни.
Кишечная микрофлора при рассеянном склерозе
Известно, что рассеянный склероз связан с нарушенной микрофлорой. Диагностируется общее снижение Бактероидов, Фирмикутов и бактерий, вырабатывающих бутират.
У мышей с экспериментальным аутоиммунным энцефаломиелитом (EAE, мышиный эквивалент рассеянного склероза у человека) была нарушена кишечная микрофлора. Антибиотики помогли сделать болезнь менее тяжелой и снизить смертность. Кроме того стерильные мыши показывали более мягкое течение EAE, что было связано с нарушением производства Th17 иммунных клеток (уменьшенное количество).
Когда стерильных мышей колонизировали бактериями, увеличивающими выработку Th17 иммунных клеток, то такие мыши начинали заболевать EAE. С другой стороны, колонизация этих мышей Бактероидами (полезными бактериями) помогало защищать от развития EAE за счет увеличения численности циркулирующих T-reg иммунных клеток.
Микрофлора кишечника при ревматоидной артрите
Наукой доказано, что экологические факторы имеют гораздо большее значение в развитии ревматоидного артрита (РА), чем генная предрасположенность. Эти предрасполагающие факторы включают в себя и здоровье микрофлоры кишечника.
У пациентов с РА было уменьшенное разнообразие микрофлоры. В исследовании с 72 участниками было продемонстрировано, что нарушение микрофлоры было больше при увеличении длительности заболевания и уровня выработке аутоантител.
Известно несколько бактерий, которые непосредственно связаны с развитием ревматоидного артрита: Collinsella, Prevotella corpi и Lactobacillus salivarius. Предрасположенные мыши, колонизированные бактериями Collinsella или Prevotella corpi показывали больший риск развития артрита, а заболевание у них протекало более тяжело.
С другой стороны, бактерии Prevotella histicola снижали частоту и выраженность ревматоидного артрита у мышей. Prevotella histicola снижала активность болезни путем увеличения количества иммунных клеток T-reg и цитокина IL-10, что уменьшало активацию воспалительных Th17-лимфоцитов.
Некоторые пробиотики показаны для улучшения симптомов у пациентов с ревматоидным артритом:
- casei (исследование 46 пациентов)
- acidophilus (исследование 60 пациентов)
- Bacillus coagulans (исследование 45 пациентов)
Микрофлора кишечника помогает улучшить прочность костей
Кишечные микробы также взаимодействует с нашими костями. Однако до сих пор эта ассоциация изучалась только у животных.
У стерильных мышей увеличивается костная масса. Эти мыши возвращаются в нормальное состояние при получении нормальной микрофлоры кишечника.
Кроме того, антибиотики привели к увеличению плотности костной массы у мышей.
А пробиотики, в основном лактобактерии, улучшили производство костей и их прочность у подопытных животных.
Дисбаланс микрофлоры способствует развитию аутизма
До 70% людей с аутизмом демонстрируют проблемы с кишечником. Эти проблемы включают в себя боль в животе, повышенную проницаемость кишечника и серьезные изменения в микрофлоре кишечника. Подобные проблемы означают, что существует прямая связь между нарушениями в кишечнике и работой мозга при аутизме.
Небольшое клиническое исследование с участием 18 детей с аутизмом попыталось включить изменение в микрофлоре с лечением основного заболевания. Такое лечение включало в себя 2-х недельный курс из приема антибиотиков, очищения кишечника и фекальной трансплантации от здоровых доноров. В результате такого лечения у детей произошли сокращения симптомов проблем с кишечником на 80% (запор, диарея, диспепсия и боль в животе). Одновременно были улучшены и поведенческие симптомы основного заболевания. Такое улучшение сохранялось 8 недель после окончания лечения.
Известно, что стерильные мыши проявляют нарушения социальных навыков. Они проявляют чрезмерное самосохранение (похожее на повторяющееся поведение у людей) и в большинстве случаев выбирают нахождение в пустом помещении, чем в присутствии с другой мышью. Если кишечник этих мышей колонизировать кишечными бактериями от здоровых мышей сразу после рождения, то некоторые, но не все, симптомы улучшаются. Это означает, что существует критический период вл время младенчества, когда кишечные бактерии воздействуют на развитие мозга.
У людей, ожирение матери может увеличить риск аутизма у детей. Вероятная причина – это дисбаланс микрофлоры кишечника.
Когда матерей мышей кормили высоким продуктами с высоким содержанием жиров, то их микрофлора кишечника становилась несбалансированной, и у их потомства возникали проблемы в социализации. Если вместе с беременной самкой жили худощавые здоровые животные, то подобные социальные нарушения у рожденных мышей возникали в очень редких случаях. Кроме того один из пробиотиков – Лактобактерии реутери (Lactobacillus reuteri) также смогли улучшить эти социальные нарушения.
Нарушенная микрофлора кишечника способна внести вклад в развитие болезни Альцгеймера
Стерильные мыши частично защищены от болезни Альцгеймера. Колонизация этих мышей бактериями от больных мышей способствовало развитию болезни Альцгеймера.
Белок, который образует амилоидные бляшки (b-амилоид) при болезни Альцгеймера, производится кишечными бактериями. Известные бактерии – Кишечная палочка и Сальмонелла энтерика (или сальмонелла кишечная, лат. Salmonella enterica), находятся в списке многих бактерий, которые вырабатывают b-амилоидные белки и могут способствовать болезни Альцгеймера.
Люди с нарушенной микрофлорой в кишечнике обладают повышенным риском развития болезни Альцгеймера:
- Хроническая грибковая инфекция может увеличить риск болезни Альцгеймера
- Люди с розацеа показывают измененную микрофлору кишечника. Они имеют повышенный риск развития слабоумия, в частности болезни Альцгеймера (исследование с участием 5.591.718 людей).
- Пациенты с диабетом умеют 2-х кратный повышенный риск развития болезни Альцгеймера (исследование с участием 1.017 пожилых людей).
Проблемы с микрофлорой кишечника увеличивают риск болезни Паркинсона
Исследование с участием 144 испытуемых показало, что люди с болезнью Паркинсона имеют измененную микрофлору кишечника. У них было уменьшено количество Prevotellaceae почти на 80%. В то же время было увеличено количество энтеробактерий.
Мыши, склонные к развитию болезни Паркинсона, имеют меньше двигательных аномалий, когда рождаются стерильными. Но если их колонизировали бактериями или давали короткоцепочечные жирные кислоты (SCFAs), то симптомы ухудшались. В этом случае антибиотики смогли помочь улучшить состояние.
Если стерильные мыши, имеющие генетическую предрасположенность к болезни Паркинсона, получали кишечные бактерии от мышей с этой болезнью, то их симптомы становились намного хуже.
Нарушенная микрофлора кишечника способна увеличить риск рака толстой кишки
Исследование 179 человек показало, что люди с диагнозом рака толстой кишки имеют повышенное соотношение Бактероиды/Превотеллы.
В другом исследовании из 27 испытуемых было продемонстрировано, что у людей с раком толстой кишки в кишечнике было больше ацетата и меньше бактерий, производящих бутират.
Кишечные и другие инфекции, а также вредные бактерии нарушают микрофлору кишечника и повышают риск развития рака толстой кишки:
- Инфекция Стрептококк бовис является фактором риска для развития рака толстой кишки (мета-анализ 24 исследований).
- Бактерия Кишечная палочка усиливает рост опухоли у мышей с воспалением кишечника.
Изменения в микрофлоре кишечника связаны с синдромом хронической усталости
В исследовании со 100 добровольцами было продемонстрировано, что синдром хронической усталости был связан с нарушениями в микрофлоре кишечника. Кроме того эти силу этих нарушений можно было связать с тяжестью заболевания.
Похожее исследование (87 участников) показало, что у пациентов с синдромом хронической усталости уменьшилось бактериальное разнообразие в кишечнике. В частности, наблюдалось уменьшение численности Фирмикут. Кишечник содержал больше воспалительных и меньше противовоспалительных видов бактерий.
Исследование с участием 20 пациентов показало, что физические упражнения вызывали дальнейшие нарушения в микрофлоре кишечника у людей с синдромом хронической усталости. Подобное ухудшение состояние можно объяснить, что при физической нагрузке происходит увеличенное проникновение через кишечный барьер вредных бактерий и их метаболитов, и распространение по кровотоку по телу.
Микрофлора способствует снижению усталости во время физической нагрузки
При опытах на животных было обнаружено, что нормализация микрофлоры кишечника смогла повысить производительность и снизить усталость во время физических тренировок. А вот стерильные мыши показали более короткие дистанции во время испытаний при плавании.
Получение пробиотика Lactobacillus plantarum способствовало увеличению мышечной массы, прочности сжатия лапы и физической работоспособности у мышей.
Бактерии кишечника влияют на старение
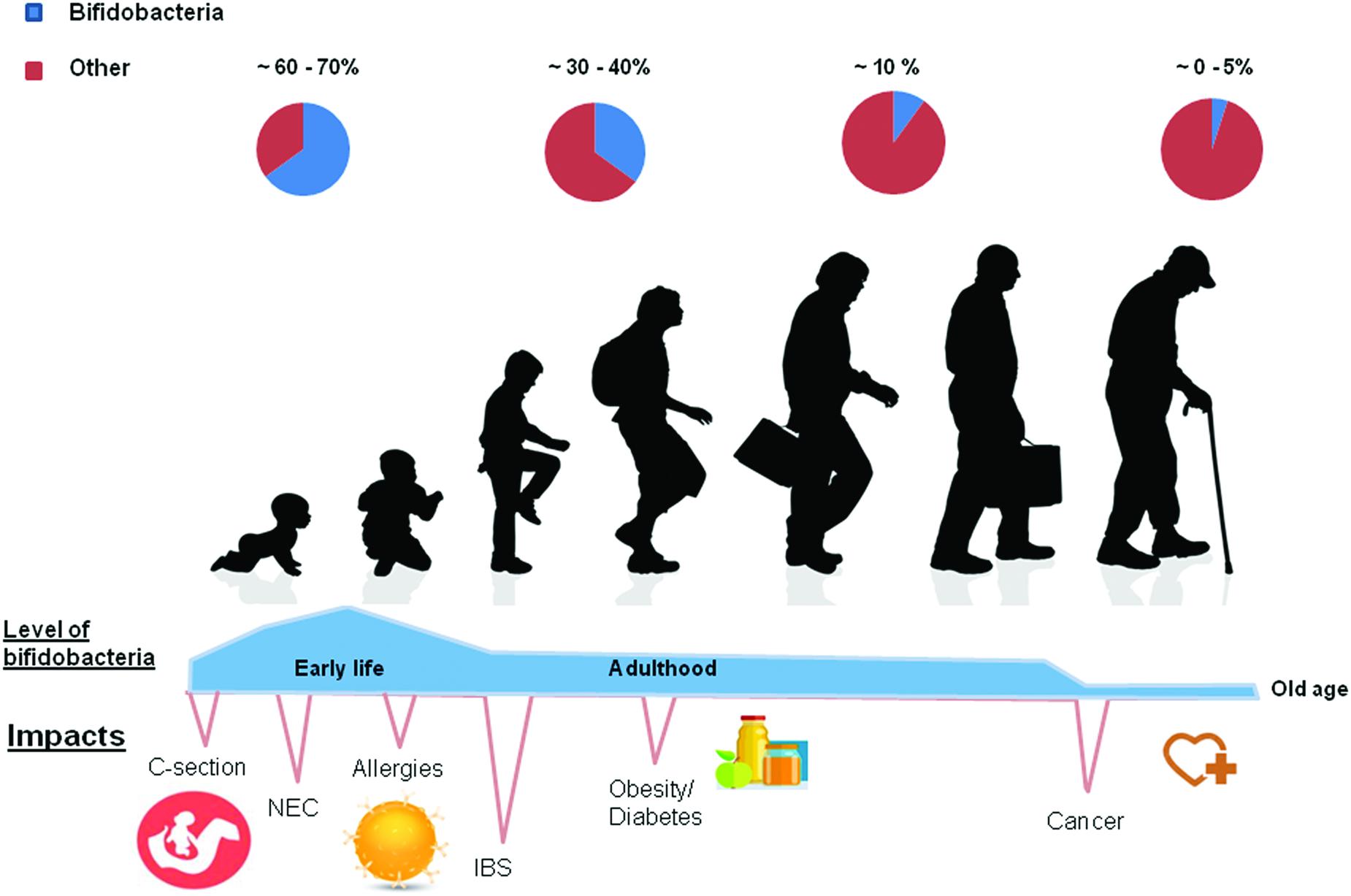
Старение часто ассоциируется с нарушениями в кишечной микрофлоре. Пожилые люди, как правило, имеют общее низкое разнообразие кишечных бактерий. Они показывают очень низкое количество Фирмикут и сильное увеличение Бактероидов.
Дисбактериоз кишечника вызывает хроническое воспаление низкой степени. Это также связано со снижением функции иммунной системы (иммуносенесценция). Оба эти состояния сопровождают многие возрастные заболевания.
Два исследования с участием 168 и 69 жителей России показали, что долгожители имели наивысшее бактериальное разнообразие. Они также обладали большим числом полезных бактерий и микробов, производителей бутирата.
Стерильные мыши живут дольше. Но если стерильных животных поселить вместе со старыми (но не молодыми) мышами, то у стерильных мышей резко увеличивались провоспалительные цитокины в крови.
Микрофлора помогает поддерживать циркадные ритмы
Кишечные бактерии имеют важное значение для поддержания циркадных ритмов. Стерильные мыши и животные, получающие антибиотики, демонстрируют нарушение циркадного ритма.
У мышей количество Бактероидов может колебаться в течение дня, в то время, как количество Фирмикутов различается незначительно.
Развитие других заболеваний из-за нарушения микрофлоры кишечника
Исследования также нашли связь между бактериями кишечника и другими расстройствами и заболеваниями. К ним относятся:
- Болезнь Бехтерева (анкилозирующий спондилит) (И, И, И, И, И)
- Шизофрения
- Расстройство пищевого поведения
- Нервная анорексия
- Булимия и психогенное переедание
- Болезни почек
- Псориаз
- Крапивница
- Акне













Подпишитесь на рассылку полезной информации
Читайте нас